【Ⅱ.界面活性剤】
1.界面活性剤の基本構造と性質
1.2 界面活性剤の構造と吸着挙動
横浜国立大学教授 大矢 勝
E-mail:moya@=@ynu.ac.jp (←@=@を@に変更してください)
界面活性剤とは一つの分子中に、「水と油のモノサシ」の上で水の性質を有した部分と油の性質を有した部分の双方を持ち合わせた物質である。一般には水の性質を有した部分を親水基、油の性質を有した部分を親油基、または疎水基と呼ぶ。「基」は分子中のある特定の性質を示す部分につける名称である。
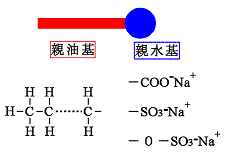
親油基は炭化水素を主体とした構造になっている。「水と油のモノサシ」の項で説明したように、アルカン(CnH2n+2)は油の性質を示す代表的な化学構造であるが、このアルカンのHがひとつとれてアルキル基(CnH2n+1-)となった構造、またその変化型が一般的な界面活性剤の親油基の大部分を占めている。
一方、界面活性剤の親水基は水中でイオン化することによって水との親和性を得るか、または水酸基(-OH)やオキシエチレン基(-CH2CH2O-)などの水に親和性のある部分を多数付け加えることによって水への親和性を確保する。イオン化する方法には、次のように界面活性剤本体が陰イオンになるもの、陽イオンなるもの、条件によって陰イオンにも陽イオンにもなることができるものの3種がある。それぞれ陰イオン界面活性剤(アニオン界面活性剤)、陽イオン界面活性剤(カチオン界面活性剤)、両性界面活性剤と呼ばれる。
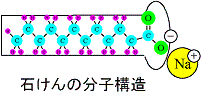
陰イオン界面活性剤はアルキル基をR-で表すとR-COONa、R-SO3Na、R-OSO3Naなどの分子式で表される。それぞれ、水中ではNa+やK+などの陽イオンを対イオンとして、界面活性剤本体はR-COO-、R-SO3-、R-OSO3-のような陰イオンになる。陽イオン界面活性剤の代表的構造としてアミン塩型とアンモニウム塩型が挙げられる。アミンとはアンモニアのHを1つ以上炭化水素基で置換したもので、Hを1つ置換したものが第1級アミン、Hを2つ置換したものが第2級アミン、Hを3つ置換したものが第3級アミンになる。アンモニウムとはNH4+であり、たとえば塩化アンモニウムならばNH4Clとなる。そしてNH4+のHを4つ炭化水素基に置換したものが陽イオン界面活性剤でよく使われる第4級アンモニウムになる。そして、Cl-などの陰イオンを対イオンとして構成され、水溶液中では界面活性剤本体は陽イオンになる。
両性界面活性剤はアルカリ性水溶液中で陰イオンに、酸性水溶液中で陽イオンになる。-NH2と-COOHの両方を有したアミノ酸型や、第4級アンモニウム塩の構造と-COO-の構造の両方を有するベタイン型などがあるが、基本的には液性によって陰イオン界面活性剤にも陽イオン界面活性剤にもなりうる界面活性剤であると理解できる。
非イオン界面活性剤は親油基はイオン性界面活性剤と変わらないが、水中でイオンになって水への親和性を得るのではなく、イオン化せずとも水への親和性を示す単位をつなぎ合わせて親水性を得る。水酸基(-OH)を多く含むタイプは多価アルコール型とよばれる。親水基に糖類の構造を利用するものは、親水性を得るために糖類の構造中の水酸基が利用されている。よって、親水基に糖類を利用する非イオン界面活性剤も、多価アルコール型に含まれる。オキシエチレン基(-CH2CH2O-)も1つの単位でやや弱い親水性を与えるが、この部分を適宜つなぎ合わせるとそれだけ大きな親水性を得ることができるので、ポリオキシエチレン型の親水基として利用される。
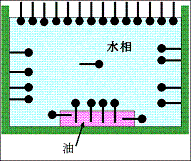
これらの界面活性剤が水中に放たれると、親水基は周りを水分子で取り囲まれることで安定化しているが、親油基は周りを水分子で取り囲まれることによって非常に不安定な状態になる。そして下図のように、水相から空気中に親油基を突き出すように水面に並んだり、水中に油性物質があれば親油基をその油性物質に差し込み、また空気や油性物質でなくても、親油基の周りを水で取り囲まれているよりはマシであるとして親水性のガラスコップの表面に向けて親油基を付着させるように並ぶ。